Por que a pressão de um gás aumenta quando ele é comprimido? A resposta a essa pergunta diz respeito ao movimento das moléculas do gás em um frasco fechado, veja:
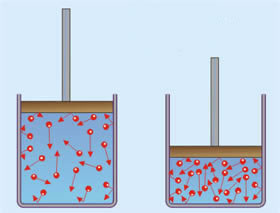
Partículas em vermelho: moléculas no estado gasoso.
Uma observação atenta à ilustração nos permite perceber que, em um espaço menor, as moléculas ficam mais concentradas. Ao comprimir um gás, esse passa a exercer certa pressão sobre as paredes do recipiente. O movimento rápido e contínuo das moléculas colidindo com as paredes é que torna o fenômeno possível.
Portanto, para aumentar a pressão de um gás não é necessário aumentar sua temperatura, basta diminuir seu volume (comprimir o gás).
Por outro lado, para um aumento da Energia cinética média (Ecin) é necessário promover uma mudança na temperatura do gás.
Ao aquecermos o gás dentro do frasco, as moléculas presentes passam a se movimentar com maior velocidade, o que ocasiona um aumento da Energia cinética média. Dizemos então que a Ecin é diretamente proporcional à temperatura, como mostra a equação:
Ecin = KT
O gás que obedece a essa equação é considerado um Gás perfeito (ou gás ideal).
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Gases – conheça mais sobre esta classe de compostos.