PUBLICIDADE
Os átomos são partículas infinitamente pequenas que constituem toda matéria no universo. Ao longo do tempo, a ideia de como seria a estrutura atômica foi mudando de acordo com as novas descobertas feitas pelos cientistas. Você poderá saber mais sobre isso no texto Evolução do Modelo Atômico.
Um modelo é uma representação da realidade (não a própria realidade), assim, os modelos atômicos são representações dos principais componentes do átomo e de sua estrutura e explicam determinados comportamentos físicos e químicos da matéria. Isso é feito porque ainda não é possível ao ser humano enxergar um átomo isolado nem mesmo com ultramicroscópios.
Para se ter uma ideia do quanto o átomo é pequeno, saiba que a menor partícula visível em um microscópio comum contém mais de dez bilhões de átomos! O átomo é tão pequeno que, se colocássemos um milhão deles lado a lado, não atingiríamos a espessura de um fio de cabelo.
Tópicos deste artigo
Mapa Mental: Átomo
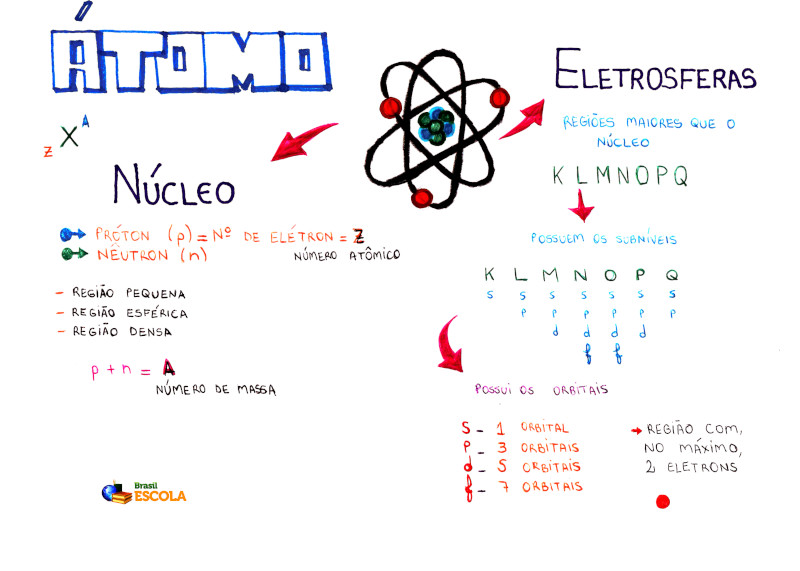
* Para baixar o mapa mental em PDF, clique aqui!
Entre os modelos atômicos, o mais usado atualmente no Ensino Médio para o entendimento da estrutura do átomo e suas propriedades é o de Rutherford-Bohr. Segundo esse modelo, a estrutura do átomo é constituída de duas partes principais: o núcleo e a eletrosfera.
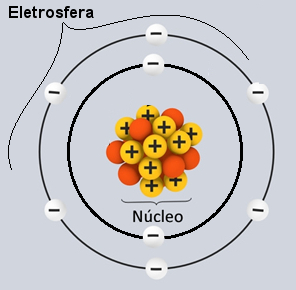
Duas partes principais da estrutura de um átomo – eletrosfera e núcleo
* Núcleo: Constituindo-se como a parte central do átomo, ele é compacto, maciço e muito denso, além de ser formado pelas partículas de maior massa, que são os prótons e os nêutrons.
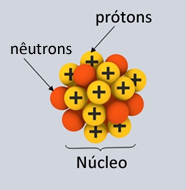
Ilustração de prótons e nêutrons que compõem o núcleo atômico
- Prótons: são partículas de carga elétrica positiva (carga relativa = +1; carga em coulomb (C) = +1,602 . 10-19) e a sua massa relativa é igual a 1.
O fato de que os prótons formam o núcleo e dão a ele uma carga total positiva foi descoberto por Eugen Goldstein, em 1886, através de uma modificação na ampola de Crookes e alguns experimentos. Ele viu que, sob voltagens elevadíssimas, apareciam emissões (raios anódicos - restos de átomos do gás que estavam dentro da ampola e que tiveram seus elétrons arrancados pela descarga elétrica). Ao colocar um campo elétrico ou magnético externo à ampola, esses raios eram desviados no sentido do polo negativo. Isso significava que existiam partículas subatômicas positivas, que foram chamadas de prótons.
Mais tarde, Ernest Rutherford (1871-1937) realizou o experimento descrito no texto O átomo de Rutherford, que o levou à descoberta da localização do próton: no núcleo.
- Nêutrons: são partículas de massa igual à dos prótons (1), mas como o próprio nome indica, eles são neutros, ou seja, não possuem carga elétrica.
Os nêutrons foram descobertos, em 1932, por James Chadwick (1891-1974), que percebeu que o núcleo do berílio radioativo emitia partículas neutras com a massa praticamente igual à massa dos prótons (na verdade, é um pouquinho maior).
O diâmetro do núcleo depende da quantidade de prótons e nêutrons que o átomo possui, mas, em média, fica em torno de 10-14 m e 10-15 m.
O núcleo atômico concentra praticamente toda a massa do átomo, sendo uma parte muito pequena mesmo: tanto o próton como o nêutron são cerca de 100 mil vezes menores do que o próprio átomo inteiro! A título de comparação, imagine que aumentássemos o núcleo do átomo do elemento hidrogênio (que possui somente um próton) até o tamanho de uma bola de tênis, o elétron mais próximo ficaria a uns três quilômetros de distância! Mesmo se um átomo fosse aumentado até ficar da altura de um prédio de 14 andares, seu núcleo seria do tamanho de um mero grão de sal no sétimo andar. É realmente algo espantoso, não acha?!
* Eletrosfera: É uma região onde os elétrons ficam girando ao redor do núcleo. Apesar de ser uma região de volume muito maior que o do núcleo, ela é praticamente vazia, pois cada elétron é 1836 vezes menor que 1 próton (ou que 1 nêutron). É por isso que a massa do átomo concentra-se praticamente toda no núcleo. Os elétrons são partículas de carga elétrica negativa (-1).
Os elétrons foram descobertos, em 1897, por Joseph John Thomson (1856-1940), o criador do modelo atômico de Thomson. O experimento de Thomson pode ser visto em detalhes no texto O experimento de Thomson com descargas elétricas, mas, de forma resumida, ele usou a ampola de Crookes já mencionada e percebeu que os raios catódicos eram sempre atraídos pelo polo positivo, o que provava que o átomo possuia partículas negativas, que foram chamadas de elétrons.
Os elétrons giram ao redor do núcleo bilhões de vezes por milionésimo de segundo, dando forma ao átomo e fazendo-o comportar-se como se fosse sólido.
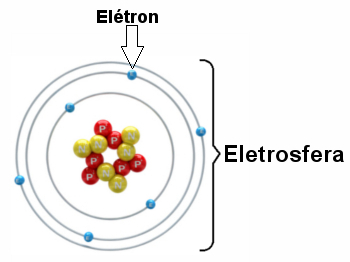
Ilustração de eletrosfera com três camadas eletrônicas e elétrons girando ao redor do núcleo
Resumidamente, podemos fazer uma tabela para diferenciar as três partículas subatômicas principais que fazem parte da estrutura do átomo:
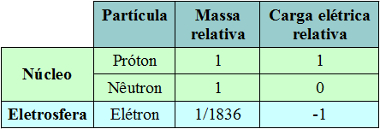
Massa e carga elétrica das três partículas subatômicas principais – prótons, nêutrons e elétrons
Os átomos de todos os elementos químicos são compostos por essas três partículas subatômicas. O que difere um elemento químico de outro é a quantidade em que essas partículas aparecem, principalmente a quantidade de prótons no núcleo, que é chamada de número atômico. Continue estudando sobre isso por meio do texto Elemento Químico.
* Mapa Mental por Me. Diogo Lopes
Por Jennifer Fogaça
Graduada em Química